Farmaci orfani: un cammino arduo
Le persone colpite da malattie rare che non hanno alcuna cura sguardo con speranza ai farmaci orfani, alcuni farmaci finalizzati a una popolazione molto piccola e il cui investimento in ricerca e sviluppo non compensa l'industria farmaceutica, se non per gli incentivi che ricevono. In occasione della Giornata Mondiale delle Malattie Rare, dedicata alla ricerca, passiamo attraverso il faticoso cammino di un orfano
di droga.Altre notizie
- I pazienti affetti da malattie rare richiedono un fondo statale per i loro trattamenti
- Quali sono biologici?
In Spagna, più di tre milioni di persone soffrono di alcune delle oltre 7.500 malattie rare o ultrarraras (quelle che colpiscono meno di 5 su 10.000 persone), ma solo il 6% ha un trattamento specifico.
Il Orfani farmaci. Esse mirano a combattere queste malattie. Del 95 approvato dalla European Medicines Agency (EMA) a partire dal 2002, 53 sono stati venduti finora in Spagna, secondo i dati dell'Associazione Spagnola aggiornato Orfani di laboratorio e Ultrahuérfanos Drugs (AELMHU).
Questa partnership riflette il fatto che ci sia una tendenza al ribasso negli ultimi anni: nel periodo 2002-2011 se i 42 farmaci orfani approvati in Europa, 38 sono stati autorizzati in Spagna (90,5%) nel periodo 2012-2015, di 44 approvato dalla EMA, solo il 13 ottiene la luce verde in Spagna (29,5%).
Per quanto riguarda il tempo trascorso da quando l'adozione da parte dell'EMA per commercializzazione in Spagna spendono una media di venti mesi.
In questo senso, la Federazione spagnola per le malattie rare (FEDER) assicura che un farmaco può richiedere fino a due anni per raggiungere le famiglie e il fatto che ogni regione si configura come un sistema autonomo non tutti allo stesso modo hanno accesso a questi farmaci, così dicono unico criterio per l'accesso e accelerare il processo di commercializzazione.
AELMHU, che riunisce più di una dozzina di aziende farmaceutiche e biotecnologiche dedicate allo sviluppo di terapie mirate innovative per i pazienti affetti da malattie rare e ultrarraras, un rapporto dal 2015 dice che "solo uno di tra 5.000 a 10.000 molecole indagate finalmente raggiunge il mercato "e che spendono tra i 10 ei 12 anni da quando la sintesi di un farmaco per il marketing.
L'investimento medio per un nuovo trattamento è 1.100 milioni di euro.

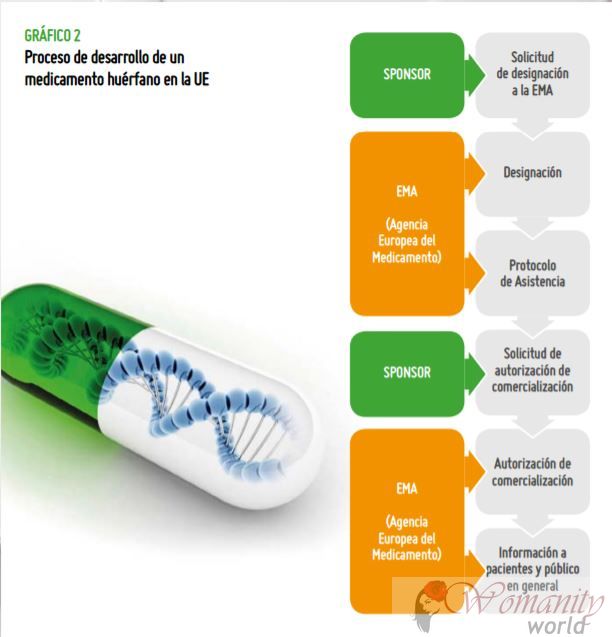
Le fasi di orfani
farmaci.Nel processo di sviluppo di un farmaco orfano ci sono due fasi principali:
1. Il Designazione viene effettuata sia dal EMA in Europa, e la Food and Drug Administration (FDA) negli Stati Uniti. Designazione indica che ci sono prove che questo farmaco può essere efficace come test preclinici. Nel EMA, in questo caso, quindi attivano aiuti o incentivi a continuare lo sviluppo clinico (test su pazienti)
- Dieci anni di esclusività nella UE dopo l'autorizzazione all'immissione in commercio.
- gratuitamente consulenza scientifica: il supporto EMA su diverse prove e sperimentazioni da effettuare per dimostrare la qualità, la sicurezza e l'efficacia del farmaco.
- Riduzione o dal pagamento delle tasse di cui alla causa.
- Promozione della ricerca: attraverso il finanziamento o di Stati membri dell'UE.
2. Il Soddisfazione Quando alla fine il farmaco mostra efficacia, la qualità e la sicurezza ed è autorizzato per la commercializzazione.
"Il problema è quello che chiamano il Death Valley Il periodo trascorso da quando la designazione di farmaco orfano riceve fino al raggiungimento di mercato ", ha detto Beatriz Gómez, responsabile del progetto presso il Centro per Biomedical Research Network sulle Malattie Rare (CIBERER).
E a questo punto si trovano di solito con l'ostacolo di ottenere finanziamenti, pubblici o privati, di intraprendere gli studi clinici, che possono durare diversi anni.
Con l'autorizzazione all'immissione in commercio è alcuna garanzia che in diversi pazienti Uniti per accedere al farmaco in quanto il processo di finanziamento e il prezzo è fatto in ogni paese.
Una guida per i ricercatori

CIBERER e l'Agenzia spagnola per medicinali e prodotti sanitari (AEMPS) ha lanciato un breve resoconto di aiutare i ricercatori nello sviluppo di farmaci orfani demistificare la complessità del processo.
CIBERER, che promuove e coordina i diversi gruppi di ricerca con progetti sulle malattie rare in tutta la Spagna, funziona anche per lo sviluppo di nuove strategie terapeutiche.
In questo senso, questo centro di ricerca ha promosso il networking e sei designati come farmaci orfani da parte della EMA, tre di loro nominati anche da parte della FDA.
Questi tre farmaci terapia genica (tecnica che sostituisce il gene mutato da un altro diritto sulle malattie genetiche rare) e altre 3 sono riposizionando farmaci già utilizzati per altre malattie che possono essere utili per alcune malattie rare. In quest'ultimo caso il costo è inferiore a